METALOENZIM DALAM TUBUH
MAKALAH
METALOENZIM
DALAM TUBUH
Makalah
ini disusun sebagai syarat menyelesaikan
Mata Kuliah Kimia Bio Anorganik yang diampu oleh Ibu Sriatun, S.Si, M.Si
Oleh
:
Oleh:
Linda
Karlina 24030110110039
Nurul
Fauziah Y. 24030110120042
Erwin Nur Cahyanto 24030110120047
Mei Viantika
Sari 24030110130055
JURUSAN
KIMIA
FAKULTAS
SAINS DAN MATEMATIKA
UNIVERSITAS
DIPONEGORO SEMARANG
2013
BAB
I
PENDAHULUAN
I.1 Latar Belakang
Tubuh manusia merupakan kumpulan sel hidup yang
bercampur, bereaksi, dan berinteraksi satu dengan yang lain membentuk suatu
susunan yang rumit tetapi terorganisasi dengan sempurna. Struktur yang teratur
tersebut terdiri atas senyawa organik dan anorganik. Berbagai senyawa organik
yang sangat penting pada tubuh manusia adalah protein yang berfungsi dalam
mempertahankan bentuk maupun sebagai enzim, hormon, atau antibodi yaitu
protein-protein aktif yang berperan dalam kelangsungan proses biokimia;
karbohidrat berperan sebagai sumber energi; asam nukleat sebagai pembentuk gen
atau faktor genetika; serta lipid yang sebagian besar terdapat dalam membran
sel.
Salah satu bentuk protein adalah enzim yang pada
umumnya memerlukan unsur runutan dalam aktivitasnya, yaitu berperan dalam
memulai dan mempercepat reaksi pada suhu tubuh. Sebanyak lebih dari 2000 reaksi
kimia berlangsung dalam tubuh manusia, di antaranya banyak yang memerlukan suhu
atau tekanan yang cukup tinggi apabila berlangsung di luar tubuh. Berkat bantuan
enzim reaksi tersebut dapat berlangsung pada suhu tubuh di bawah tekanan udara
normal. Ditinjau dari fungsinya unsur runutan pada umumnya merupakan bagian
dari sistem enzim, yaitu berupa metaloenzim dan kompleks logam-enzim. Pada
metaloenzim unsur logam terdapat dalam jumlah tertentu dan merupakan bagian
integral dari molekul enzim. Unsur Zn merupakan logam yang pertama kali
teridentifikasi masuk dalam kategori ini yaitu dalam karbonik-anhidrase.
Perkembangan selanjutnya membuktikan bahwa metaloenzim-Zn berperan sangat luas
dalam proses metabolisme karbohidrat, lipid, protein dan asam nukleat, yaitu
metaloenzim alkohol- dehidrogenase, laktat-dehidrogenase, karboksi-peptidase A
dan B, serta alkali- fosfatase. Unsur Zn juga merupakan bagian yang vital dari DNA
dan RNA-polimerase. Pada penelitian-penelitian selanjutnya kemudian ditemukan
banyak sekali metaloenzim lain yang terdapat dan diperlukan oleh tubuh.
Meninjau begitu pentingnya metalloenzim dalam tubuh sehingga diperlukan
pembahasan yang lebih dalam mengenai metaloenzim itu sendiri.
I.2 Rumusan Masalah
1. Apakah
yang disebut dengan metaloenzin?
2. Apakah
peran metaloenzim dalam tubuh?
3. Apa
sajakah jenis-jenis metaloenzim?
4. Bagaimanakah
mekanisme kerja metabolisme dalam tubuh?
I.3 Tujuan
Tujuan pembuatan makalah ini adalah
1. Mengetahui
definisi metaloenzim
2. Mengetahui
peran metaloenzim dalam tubuh
3. Mengetahui
jenis-jenis metaloenzim
4. Mengetahui
mekanisme kerja metaloenzim dalam tubuh
BAB II
METALOENZIM
2.1.
ENZIM
A. Pengertian
Enzim merupakan protein yang berfungsi sebagai biokatalis
dalam sel hidup. Enzim telah banyak digunakan dalam bidang industri pangan,
farmasi dan industri kimia lainnya. Dalam bidang pangan misalnya amilase,
glukosa-isomerase, papain, dan bromelin, sedangkan dalam bidang kesehatan
contohnya amilase, lipase, dan protease. Enzim dapat diisolasi dari hewan,
tumbuhan dan mikroorganisme. Kelebihan enzim dibandingkan katalis biasa adalah
: dapat meningkatkan produk beribu kali lebih tinggi; bekerja pada pH yang
relatif netral dan suhu yang relatif rendah; dan bersifat spesifik dan selektif
terhadap subtrat tertentu.
Pada enzim terdapat
bagian protein yang tidak tahan panas yaitu disebut dengan apoenzim, sedangkan
bagian yang bukan protein adalah bagian yang aktif dan diberi nama gugus
prostetik, biasanya berupa logam seperti besi, tembaga , seng atau suatu bahan
senyawa organic yang mengandung logam. Apoenzim dan gugus prostetik merupakan
suatu kesatuan yang disebut holoenzim, tetapi ada juga bagian enzim yang apoenzim
dan gugus prospetiknya tidak menyatu. (Azmi, 2006)
B.
Klasifikasi
Enzim
Klasifikasi enzim menurut Azmi (2006) adalah:
1. Oksidoreduktase
Mengkatalisis reaksi oksidasi-reduksi, dan
biasanya menggunakan koenzim NAD+ dan NADP+. Yang
termasuk enzim ini dengan nama trivial: Dehidrogenase, Oksidase, dan
Hidroksilase.
2. Transferase
Mengakatalisis pemindahan gugus tertentu, seperti gugus 1-karbon, gugus
aldehid, dan keton, gugus alkil, gugus glikosil, gugus fosfat dan gugus yang
mengandung S. Yang termasuk enzim ini dengan nama trivial adalah: Amino,
Transferase, Asil Karnitin Transferase, Transkarboksilase
3. Hidrolase
Meningkatkan pemecahan ikatan antara karbon dan atom lainnya dengan
penambahan air. Yan gtermasuk enzim ini dengan nama trivial: Esterase, Amidase,
Peptidase.
4. Liase
Mengkatalisis pemecahan karbon-karbon,
karbon-sulfur, dan karbon-nitrogen. Yang termasuk enzim ini dengan nama
trivial: Dekarboksilase, Aldolase, dan Sintase
5. Isomerase
Mengkatalisis rasemisasi optik atau isomer geometri dan reaksi
oksidasi-reduksi intra molekular tertentu. Yang termasuk enzim ini dengan nama
trivial: Epimerase, Mutase, dan Isomerase.
6. Ligase
Mengkatalisis pembentukan ikatan antara karbon dengan karbon, karbon dengan
sulfur, karbon dengan nitrogen, dan karbon dengan oksigen. Untuk pembentukan
ikatan tersebut diperlukan energi yang berasal dari ATP. Yang termasuk enzim
ini dengan nama trivial: Sintetase dan Karboksilase.
C.
Sifat-Sifat Enzim
Sifat-sifat
enzim menurut Deswita (2006) adalah:
1.
Enzim adalah Protein
Sebagai protein enzim memiliki sifat
seperti protein, yaitu sangat dipengaruhi oleh kondisi lingkungan, seperti
suhu, pH, konsentrasi substrat). Jika lingkungannya tidak sesuai, maka enzim
akan rusak atau tidak dapat bekerja dengan baik.
2.
Bekerja secara khusus/spesifik
Setiap enzim memiliki sisi aktif yang
sesuai hanya dengan satu jenis substrat, artinya setiap enzim hanya dapat
bekerja pada satu substrat yang cocok dengan sisi aktifnya.
3.
Berfungsi sebagai katalis
Meningkatkan kecepatan reaksi kimia
tanpa merubah produk yang diharapkan tanpa ikut bereaksi dengan substratnya,
dengan demikian energi yang dibutuhkan untuk menguraikan suatu substrat menjadi
lebih sedikit.
4.
Diperlukan dalam jumlah sedikit
Reaksi enzimatis dalam metabolisme hanya
membutuhkan sedikit sekali enzim untuk setiap kali reaksi.
5.
Bekerja bolak-balik
Enzim tidak mempengaruhi arah reaksi,
sehingga dapat bekerja dua arah (bolak-balik). Artinya enzim dapat menguraikan
substrat menjadi senyawa sederhana, dan sebaliknya enzim juga dapat menyusun
senyawa-senyawa menjadi senyawa tertentu.
6.
Enzim bersifat khusus terhadap suatu
substrat tertentu yang dapat diikat dan jenis reaksinya.
7.
Kerja enzim dipengaruhi oleh lingkungan,
seperti oleh suhu, pH, konsentrasi, dll.
D. Komponen
Enzim Substrat
Enzim merupakan senyawa organik berupa protein yang berfungsi
sebagai katalis dalam metabolisme tubuh, sehingga disebut juga biokatalisator.
Komponen
penyusun enzim terdiri dari :
1.
Apoenzim, yaitu bagian enzim aktif yang
tersusun atas protein yang bersifat labil (mudah berubah) terhadap faktor
lingkungan, dan
2.
Kofaktor,yaitu komponen non protein yang
berupa :
a.
Ion-ion anorganik (aktivator)
Berupa logam yang berikatan lemah dengan
enzim, Fe, Ca, Mn, Zn, K, Co. Ion klorida, ion kalsium merupakan contoh ion
anorganik yang membantu enzim amilase mencerna karbohidrat (amilum)
b.
Gugus prostetik
Berupa senyawa organik yang berikatan
kuat dengan enzim, FAD (Flavin Adenin Dinucleotide), biotin, dan heme merupakan
gugus prostetik yang mengandung zat besi berperan memberi kekuatan ekstra pada
enzim terutama katalase, peroksidae, sitokrom oksidase.
c.
Koenzim
Berupa molekul organik non protein
kompleks, seperti NAD (Nicotineamide Adenine Dinucleotide), koenzim-A, ATP, dan
vitamin yang berperan dalam memindahkan gugus kimia, atom, atau elektron dari
satu enzim ke enzim lain.
E. Cara
kerja Enzim
Cara enzim bekerja adalah dengan
membentuk senyawa enzim-substrat, kemudian menghasilkan suatu produk tanpa
merubah senyawa enzim itu sendiri, setelah produk terbentuk maka enzim akan
melepaskan diri untuk membentuk senyawa baru dengan substrat yang lain.
Ada 2 (dua) cara kerja enzim :
1.
Lock and key (gembok
dan anak kunci)
Setiap enzim memiliki sisi aktif yang
tersusun dari sejumlah asam amino. Bentuk sisi aktif ini sangat spesifik,
sehingga hanya molekul dengan bentuk tertentu yang dapat menjadi substrat bagi
enzim.
2.
Induced fit (induksi pas)
Sisi
aktif enzim merupakan bentuk yang tidak kaku (fleksibel). Ketika substrat
memasuki sisi aktif enzim, bentuk sisi aktif berubah bentuk sesuai dengan
bentuk substrat kemudian terbentuk kompleks enzim-substrat. Pada saat produk
sudah terlepas dari kompleks, maka enzim lepas dan kembali bereaksi dengan
substrat lain.
Beberapa
enzim dapat bekerja sendiri ,yang lain
bekerja sama yang disebut dengan
kofaktor, yang tersusun atas ion logam
dan molekul anorganik. Sebagian enzim
yang dikenal mengandung atau memerlukan logam yang berikatan secara kovalen
atau nonkovalen untuk aktivitasnya.
2.2. METALOENZIM
A.
Pengertian
dan Fungsi Metaloenzim
Logam mempunyai peran penting dalam
sekitar sepertiga dari enzim yang dikenal. Logam dapat berupa co-faktor atau
bisa digabungkan ke dalam molekul, dan ini dikenal sebagai metalloenzymes.
Metalloenzymes adalah protein yang berfungsi sebagai enzim dan mengandung logam
yang terikat erat dan selalu terisolasi dengan protein. Asam amino dalam
peptida linkage memiliki gugus yang dapat membentuk ikatan kovalen
koordinat-dengan atom logam. Kelompok Karboksi dan Amino bebas mengikat logam
mempengaruhi struktur enzim yang mengakibatkan konformasi aktif.
Fungsi utama Logam adalah bertugas
dalam transfer elektron. Banyak enzim dapat berfungsi sebagai elektrofil dan
beberapa dapat berfungsi sebagai kelompok nukleofilik. Fleksibilitas ini
menjelaskan sering terjadinya logam dalam enzim. Beberapa metalloenzymes
meliputi hemoglobin, sitokrom, phosphotransferases, alkohol dehidrogenase,
arginase, ferredoxin, dan sitokrom oksidase.
B.
Struktur
Metaloenzime
Dalam protein seperti hemoglobin dan
sitokrom, logam yang terkandung adalah Fe2+ atau Fe3+,
dan itu adalah bagian dari kelompok heme prostetik. Dalam metalloenzymes lain,
logam dibangun ke dalam struktur molekul enzim. Ion logam tidak dapat
disingkirkan tanpa menghancurkan struktur enzim.
Logam biasanya ditemukan di situs
aktif enzim. Logam menyerupai proton (H +) dimana mereka merupakan elektrofil
yang dapat menerima pasangan elektron untuk membentuk ikatan kimia. Dalam aspek
ini, logam dapat bertindak sebagai asam umum untuk bereaksi dengan anionik dan ligan
netral .
Logam ukuran yang lebih besar
dibandingkan dengan proton dikompensasikan dengan kemampuan mereka untuk bereaksi
dengan lebih dari satu ligan. Logam biasanya bereaksi dengan dua, empat, atau
enam ligan. Ligan adalah molekul apapun yang berinteraksi dengan logam.. Jika
logam terikat dengan dua ligan akan membentuk kompleks linear. Jika logam
bereaksi dengan empat ligan logam akan ditetapkan di tengah persegi yang planer
atau akan membentuk struktur tetrahedral, dan ketika enam ligan bereaksi, logam
berada tengah sebuah segi delapan.
Asam amino dalam ikatan peptida
dalam protein memiliki kelompok dengan kemampuan untuk mengikat logam yang
mengakibatkan adanya ikatan kovalen koordinat-. Gugus amino dan karboksil bebas
dalam protein dapat mengikat logam yang dapat mengikat protein tertentu,
konformasi aktif. Fakta bahwa logam mengikat beberapa ligan penting bahwa logam
tersebut berperan dalam membawa bagian-bagian terpencil dari urutan asam amino
bersama-sama dan membantu membangun konformasi aktif enzim.
C.
Fungsi
Umum Metalloenzyme
b.
Hemoglobin
Sebuah
molekul dengan empat subunit, mengandung atom besi di setiap subunit, di mana
masing-masing subunit mengikat satu molekul oksigen. Hemoglobin mengangkut
oksigen dari paru-paru ke kapiler dari jaringan.
c.
Sitokrom
Sitokrom
adalah protein membran integral. Sitokrom mengandung zat besi yang berfungsi
untuk membawa elektron antara dua segmen dari rantai transpor elektron. Besi merupakan
logam reversible yang dapat teroksidasi dan berfungsi sebagai akseptor elektron
sebenarnya untuk sitokrom.
d.
Phosphotransferase
Ion Mg2+
juga berperan dalam transfer elektron.
e.
Dehidrogenase
alkohol
Sebuah
metalloenzyme seng dengan spesifisitas luas. Mereka mengoksidasi berbagai
alkohol alifatik dan aromatik ke aldehida dan keton yang sesuai menggunakan NAD
+ sebagai koenzim.
f.
Arginase
Logam atom
Mn2 + digunakan dalam transfer elektron.
g.
Ferredoxin
Sebuah elektron
mentransfer protein yang terlibat dalam proses transfer satu elektron.
h.
Oksidase
sitokrom
Ion-ion
tembaga dengan mudah mengakomodasi elektron dihapus dari substrat dan dapat
dengan mudah mentransfernya ke molekul oksigen
Tabel
beberapa metalloenzim
Mg2+
|
Phosphohidrolase
Phosphotransferase
|
Mn2+
|
Arginase
Phosphotransferase
|
Fe 2+ dan Fe 3+
|
Cytochromes
Peroxidase
Katalase
Ferredoksin
|
Cu2+ atau Cu+
|
Tirosinase
Amina oksidase
Ascorbate oxidase
Galaktose oksidase
Dopamine-β-hidrosilase
|
Zn2+
|
Alkohol dehidrogenase
Alkalin phospotase
Carbonic anhidrase
Carboxipeptidase
|
Fe dan Mo
|
Nitrogenase
|
D. Regulasi
Metaloenzim
Sekitar
sepertiga dari enzim yang dikenal memiliki logam sebagai bagian dari struktur
mereka, diperlukannya logam ditambahkan untuk aktivitas atau lebih diaktivasi
oleh logam. Di dalam enzim yang logamnya telah digabungkan ke dalam struktur
molekul enzim, logam tidak dapat dihapus tanpa merusak struktur itu. Enzim
tersebut termasuk metalloflavoproteins, sitokrom, dan ferredoxins. Dalam enzim dimana
logam ini harus ditambahkan untuk aktivitas logam bereaksi reversibel dengan
protein untuk membentuk kompleks logam-protein yang merupakan katalis aktif.
Dalam banyak kasus, kompleks merupakan spesifik, konformasi aktif secara
katalitik protein, peran logam tampaknya menjadi salah satu yang menstabilkan
konformasi protein tersebut.
Karena
merupakan gabungan, metalloenzymes yang begitu besar dan luas itu akan hampir
mustahil untuk menjelaskan bagaimana mereka dapat dikendalikan dan diatur. Dalam
hal ini, penting untuk menjelaskan bagaimana fungsi penting dari logam dalam
enzim dapat terganggu dan terhambat. Logam menyerupai proton (H +) yang
merupakan elektrofil yang mampu menerima pasangan elektron untuk membentuk
ikatan kimia. Dengan demikian, logam dapat bertindak sebagai asam umum untuk
bereaksi dengan ligan anionik dan netral. Karakteristik logam ini sangat
membantu dalam struktur dan fungsi enzim tetapi membuat enzim tergantung
terhadap pengaturan pH. Perubahan pH dapat mengganggu aliran elektron dimana logam
biasanya akan membantu memfasilitasinya, sehingga dengan demikian menghambat
keefektifan metalloenzyme tersebut.
Karena
variabilitas yang terdapat pada logam memnghasilkan kemampuan untuk bereaksi
dengan lebih dari satu ligan, menyebabkan logam berperan sebagai bagian dari
situs aktif di banyak metalloenzymes. Inhibitor kompetitif dalam bentuk analog keadaan
transisi adalah senyawa yang diyakini terlihat seperti substrat dalam keadaan
transisi. Supaya efektif, analog keadaan transisi tidak boleh rentan terhadap
reaksi yang dilakukan oleh enzim.
2.3. NITROGENASE
A.
Pengertian Enzim Nitrogenase (Fe-S)
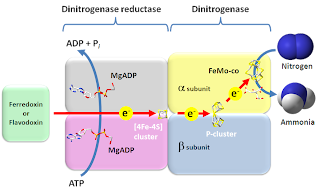
Nitrogenase adalah enzim yang dapat
mereduksi gas nitrogen di udaramenjadi amonia. Gas nitrogen yang berada di alam
sebanyak 78% dari komposisi udara tidak dapat digunakan oleh tanaman, oleh karena itu perlu diubah terlebih dahulu menjadi
bentuk lain, salah satunya molekul amonia. Enzim nitrogenase terbagi menjadi
dua yaitu dinitrogen reduktase yang memiliki molekul protein Fe dan dinitrogenase
yang memiliki molekul protein Mo-Fe. Nitrogenase akan menjadi inaktif apabila
terdapat oksigen yang bereaksi dengan komponen Fe dari protein.
Enzim nitrogenase dimiliki
oleh bakteri penambat nitrogen. Enzim ini bersifat konservatif karena memiliki
struktur gen yang sama, hanya saja ekspresinya yang berbeda. Aktivitas enzim
nitrogenase dapat diukur dengan metode Asai Reduksi Asetilen (ARA). Nitrogenase
merupakan enzim yang digunakan oleh beberapa organisme untuk mengarahkan
keberadaan nitrogen di atmosfir. Nitrogenase membantu memelihara keseimbangan
senyawa di udara, mencegah kelebihan nitrogen di udara. Nitrogenase penting di
dalam proses pemecahan ikatan rangkap tiga pada senyawa nitrogen. Nitrogen
berperan sebagai katalis untuk mengikat 3 atom hidrogen ke nitrogen sehingga
menghasilkan senyawa amonia. Nitrogenase merupakan kompleks enzimatik yang
dapat memfiksasi nitrogen di udara. Komplkes nitrogenase berada bebas di dalam
organisme yang memfiksasi nitrogen dan juga berada di dalam bakteri yang
memfiksasi nitrogen yang bersimbiosis. Berikut persamaan reaksi pembentukan
amonia dari nitrogen :
Amonia dibentuk pada proses ini
diinkorporasikan ke dalam asam amino glutamat dan glutamin serta asam nukleat.
Kompleks nitrogenase mengandung 2 tipe protein. Protein pertama memiliki berat
molekul (BM) 220 kDa. Protein ini dibentuk dari 4 subunit yang mengandung 28
ion Molibdenum sebagai kofaktor. Protein kedua memiliki BM 70 kDa, dibentuk
dari 2 subunit yang mengandung 8 atom besi sebagai kofaktor. Kofaktor logam
baik Fe maupun Mo meletakkan nitrogen di dalam posisi yang mana mudah untuk
dikonversi menjadi amonia. Kedua protein tersebut bersama-sama memfiksasi
nitrogen di udara. Kompleks nitrogen ini sangat sensitif terhadap oksigen.
Oksigen dapat menginaktivasi aktivitas nitrogenase. Oleh karena itu, pada
tumbuhan, untuk mencegah pertemuan molekul oksigen dengan nitrogenase, tumbuhan
memproduksi hemoglobin khusus pada tumbuhan yang dinamakan laghemoglobin.
Protein ini memiliki afinitas tinggi terhadap oksigen dan mengikat oksigen.
Protein ini diinisiasikan di sekitar akar untuk mencegahdari jangkauan nitrogenase.
B.
Metabolisme Nitrogen
Nitrogen berada dialam dalam
berbagai bentuk dan keadaan dinamis mengikuti perubahan fisik dan kimia dalam
suatu daur nitrogen. Sejumlah besar nitrogen dalam atmosfer, namun sukar bagi
tumbuhan untuk memperoleh atom N dari N2 dalam bentuk yang
dapat digunakan. Meskipun N2 masuk kedalam sel-sel daun bersama CO2 melalaui
stomata, enzim-enzim yang tersedia hanya mereduksi CO2, sehingga N
keluar dari sel-sel daun secepat mungkin. Sebagian besar N2 yang
masuk tubuh tumbuhan telah mengalami fiksasi (reduksi) oleh mikroba prokariotik
atau dalam bentuk NH4 dan NO3dalam air hujan atau
aktifitas gunung berapi dan pembakaran fosil.
Perubahan nitrogen organik menjadi
NH4 oleh mikroba tanah disebut amonifikasi, NH4 dioksidasi
lebih lanjut oleh bakteri menjadi NO3- yang disebut
nitrifikasi. Sedangkan proses terbentuknya N2, NO, N2O,
dan NO2 dari NO3oleh bakteri anaerob adalah
denitrifikasi.
C.
Siklus Nitrogen
Nitrogen ditemukan pada semua asam
amino, yang merupakan penyusun protein organisme-organisme. Nitrogen tersedia
bagi tumbuhan hanya dalam bentuk dua mineral, yaitu NH4 (amonium)
dan NO3- (nitrat). Meskipun atmosfer bumi hampir 80%
terdiri dario nitrogen, unsur ini sebagian besar terdapat dalam bentuk gas
nitrogen (N2) yang tidak tersedia bagi tumbuhan.
Nitrogen memasuki ekosistem melalui
dua jalur alamiah, yang keutamaan relatifnya sangat bervariasi dari ekosistem
ke ekosistem yang lain. Yang pertama, deposit pada atmosfer, merupakan 5-10 %
dari nitrogen yang dapat digunkan yang memasuki sebagian besar ekosistem. Dalam
proses ini, NH4+ dan NO3-,
kedua bentuk yang tersedia bagi tumbuhan, ditambahkan ketanah melalui
kelarutannya dalam air hujan atau melalui pengendapan debu-debu halus atau
butiran lainnya.
D.
Reaksi-reaksi Pembentukan Enzim Nitrogenase (Fe-S)
a. Reaksi
Oksidasi
Gambar : Reaksi Oksidasi Nitrogen
Reaksi
reduksi gas nitrogen menjadi amonia terjadi apabila molekul gas nitrogen
terikat pada komplek enzim nitrogenase. Tiap reaksi memerlukan elektron
yang disumbangkan oleh feredoksin. Dinitrogen reduktase mula-mula direduksi
oleh elektron yang diberikan oleh feredoksin yang dihasilkan melalui
fotosintesis, respirasi, atau fermentasi. Dinitrogen reduktase yang tereduksi
akan mengikat ATP (adenosin trifosfat) dan mereduksi dinitrogenase yang
memberikan elektron kepada gas nitrogen sehingga menghasilkan NH=NH. Pada daur
berikutnya NH=NH direduksi menjadi amino nitrogen dan selanjutnya direduksi
lagi menjadi dua molekul NH3. Dua molekul amonia dihasilkan dari
satu molekul gas nitrogen menggunakan 16 molekul ATP serta pasokan elektron
dan proton yang berupa ion hydrogen.
b. Fiksasi
Nitrogen
Reaksi
yang mengubah nitrogen di udara menjadi amonia adalah dasar kehidupan. Fiksasi
nitrogen, reaksi yang mengikat nitrogen di atmosfer menjadi amonia, dilakukan
oleh Rhizobium di akar tumbuhan polong-polongan atau oleh bakteri di alga dalam
atmosfer anaerobik. Semua hewan, tanaman, termasuk manusia, bergantung pada
fiksasi nitrogen biologis untuk mendapatkan nitrogen bagi penyusunan
protein dan senyawa lain yang mengandung nitrogen sebelum ada proses
Harber-Bosch.
N2 + 8 H+ + 8 e + 16
MgATP → 2 NH3 + H2 +16 MgADP + 16Pi
(Pi adalah fosfat anorganik).
Suatu
enzim yang dinamakan nitrogenase mengkatalisis reaksi ini. Nitrogenase
mengandung protein besi-belerang dan besi-molibdenum, dan mereduksi nitrogen
dengan koordinasi dan transfer elektron dan proton secara kooperatif, dengan
menggunakan MgATP sebagai sumberenergi. Karena pentingnya reaksi ini,
usaha-usaha untuk mengklarifikasi struktur nitrogenase dan mengembangkan
katalis artifisial untuk fiksasi nitrogen telah dilakukan secara kontinyu
selama beberapa tahun. Baru-baru ini, struktur pusat aktif
nitrogenase yang disebut dengan kofaktor besi-molibdenum telah ditentukan
dengan analisis kristal tunggal dengan sinar-X.
Menurut
hasil analisis ini, strukturnya memiliki kluster Fe3MoS4 dan
Fe4S4 yang dihubungkan melalui S.
Dipercaya
bahwa dinitrogen diaktivasi dengan koordinasi antara dua kluster. Di pihak
lain, bagian yang disebut dengan kluster p yang terdiri dari dua kluster
Fe4S4 clusters. Peran dan mekanisme reaksi
kedua kluster ini belum jelas.
c. Asimilasi
Nitrat
Jumlah
relatif NO3- dan nitrogen organik dalam xylem
bergantung pada kondisi lingkungan. Jenis tumbuhan yang akarnya mampu
mengasimilasi N, dalam cairan Xylem dijumpai banyak asam amino, amide an urine,
tidak dijumpai NH4+. Sedangkan jika di dalm cairan xylem
mengandung NO3- berarti akar tumbuhan itu tidak
mampu mengasimilasi NO3-. Kalau dlam lingkungan perakaran
NO3- terdapat dalam jumlah besr, cairan xylem akan mengandung NO3- juga.
Proses keseluruhan reduksi NO3- menjadi NH4 yaitu:
a)
Reduksi
Nitrat
------->
NO3- + NADH -> NO2+ + NAD +
H2O
Reaksi ini
berlangsung di sitosol, enzim yang mengkatalis adalah nitrat reduktase, enzim
yang memindahkan dua elektron dari NADPH2, hasilnya adalah nitrite, NAD (NADP)
dan H2O. Nitrat reduktase adalh suatu enzim besar dan kompleks yang
terdiri dari FAD, satu sitokrom dan Molibdenum (Mo) yang semuanya akan
tereduksi dan teroksidasi pada waktu elektron diangkut dari NADH2 ke
atom nitrogen dalm NO3
b)
Reduksi
Nitrit
------>
NO2 + 3 H2O + 6 Fd +2 H+ + cahaya -> NH4+ +
1,5O2 +3 H2O + 6 Fd
Reaksi ini
berlangsung di kloroplas (pada daun) atau pada proplastida (pada akar), dengan
enzim Nitrit reduktase. Meskipun Fd tereduksi merupakan donor elektron yang
khas bagi nitrit reduktase di daun.
d. Pengubahan
NH4+ mejadi senyawa organik
NH4+ (ammonium)
yang diserap langsung dari tanah atu yang dihasilkan oleh fiksasi N2 tidak
pernah dijumpai tertimbun dalam tubuh tumbuhan. Ammonium ini bersifat racun,
mungkin menghambat pembentukan ATP dalam kloroplas maupun dalam mitokndria.
Ammonium ini segera ditangkap oleh asam glutamat untuk menjadi glutamine dengan
enzim glutamine sintetase, glutamin direaksikan dengan asam α keto glutarat
menjadi 2 molekul asam glutamate. Untuk reaksi ini juga diperlukan elektron
yang bersal dari Fd (dalam kloroplas) dan NADH atau NADPH2 dalam
proplastida dari sel-sel non-fotosintetik. Salah satu dari kedua glutamate yang
terbentuk diperlukan untuk mempertahankan reaksi 1, sedang glutamat yang kedua
dapat berubah langsung menjadi protein atau asam amino lain yang diperlukan
untuk sintesis protein, klorofil, asam nukleat dan lain-lain. Selain membentuk
glutamate, glutamine dapat memberikan gugus amide-nya kepada asam aspartat
untuk menjadi asparagin yang dikatalis oleh enzim asparagin sintetase. Glutamin
dan asparagin menjadi senyawa nitrogen organik pertama yang terbentuk,
selanjutnya gugus NH2 dapat diberikan kepada α keto
karboksilat, membentuk asam amino. Proses ini dinamakan transaminasi. Dengan
transaminasi berbagai asam amino dapat dibuat, tergantung pada α keto
karboksilatnya
BAB III
PENUTUP
KESIMPULAN
1.
Metalloenzymes
adalah protein yang berfungsi sebagai enzim dan mengandung logam yang terikat
erat dan selalu terisolasi dengan protein
2.
Beberapa
metalloenzymes meliputi hemoglobin, sitokrom, phosphotransferases, alkohol
dehidrogenase, arginase, nitrogenase, ferredoxin, dan sitokrom oksidase.
3.
Nitrogenase adalah enzim yang dapat
mereduksi gas nitrogen di udara menjadi amonia Enzim nitrogenase dimiliki oleh
bakteri penambat nitrogen. Enzim ini bersifat konservatif karena memiliki
struktur gen yang sama, hanya saja ekspresinya yang berbeda.
4.
Pada metabolisme tumbuhan akan mengalami
friksasi nitrogen dimana suatu tahapan yang sangat penting dalam siklus
nitrogen, sehingga menghasilkan nitrogen yang dapat digunakan sebagai nutrisi
tumbuhan.
DAFTAR
PUSTAKA
Chem-Is-Try.Org _ Situs
Kimia Indonesia _.htm
Darmono.
1995. Logam dalam Sistem Biologi Makhluk Hidup. Jakarta : Universitas Indonesia
(UI-Press)
Oelze
J. 2000. Respiratory protection of nitrogenase in Azotobacter species: Is a
widely-held hypothesis unequivocally supported by experimental evidence? FEMS
Microbiol Rev. 24(4):321–33.
Seefeldt
LC, Dance IG, Dean DR. 2004. Substrate interactions with nitrogenase: Fe versus
Mo. Biochemistry. 43(6):1401-9.
Sugiyanto H.K dan Retno
D.S. 2010. Kimia Anorganik Logam. Yogyakarta : Graha Ilmu.




0 komentar :
Posting Komentar